Korozyon
Korozyon, malzemenin çevresiyle reaksiyona girerek oluşturduğu bir bozulma sürecidir. Korozyonun ciddi sonuçları nedeniyle dünya ölçeğinde bir problem olmuştur.
Günlük hayatımızda da karşılaştığımız korozyon, işletme duruşlarına hatta kapanmalarına, değerli kaynakların harcanmasına, ürünlerin bozulması veya kaybına, verimlilik düşüşüne, yüksek maliyetli onarımlara ve gereğinden pahalı dizaynlara neden olmaktadır. Korozyon birden çok bilimsel alanın ilgi alanına girmesiyle ve sorumlulukların nerede başlayıp nerede bittiği karmaşasıyla kompleks bir problemdir.
Korozyon kontrolü; sürec tanınır, mekanizmaları anlaşılır, korozyon direnci yüksek malzemeler kullanılır, uygun dizayn yapılır ve koruyucu sistemler kullanılırsa etkili olabilir. Büyük kuruluşlar, ilgili endüstri dalları, devlet kuruluşları korozyon ilintili problemleri ele almak için guruplar ve komiteler kurmuşlardır.
Korozyon Hücresi
Korozyon, elektron ve iyon akışını gerektiren bir elektrokimyasal süreçtir.
Metal kaybı (korozyon) anotta meydana gelir.
Katotta metal kaybı olmaz. (Katot korunmaktadır.)
Elektrokimyasal korozyon, metal ile elektrolit ara yüzeyinde elektron transferini gerektirir.
Korozyon 4 kısımdan oluşan bir korozyon hücresinde meydana gelir.
– Anot
– Katot
– Elektrolit
– Metalik bağ
Anotta metalik iyonlar üretimi sayesinde oluşan elektronlar elektriksel yol üzerinden geçerek elektrolite daldırılmış katodik yüzeye geçerler.
Elektrolitte bulunan pozitif yüklü iyonlarla reaksiyona girerek elektriksel dengeyi tekrar kurarlar.
Şekilde ki gibi korozyon sürecini su içinde aynı metalik yüzeyde bulunan bir anot ve bir katottan oluşan bir korozyon hücresinde inceleyelim;
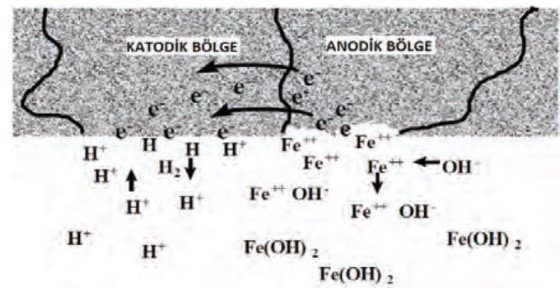
Aynı metal anot, katot ve elektriksel yolu (metalik bağ) içerir.
Su ise korozyon hücresinin son bileşenini, yani elektroliti sağlar.
Elektrolit (sulu çözelti), küçük miktarlarda hidrojen (H+) ve hidroksil (OH–) iyonları bulunduracak şekilde iyonize olmuştur.
Metal iyonları,geride elektriksel yol üzerinden katodik yüzeye akacak elektronları bırakarak elektrolite girmek üzere anodik yüzeyden ayrılır.
Katodik yüzeyde, anottan gelen elektronlar elektrolitteki hidrojen iyonları ile karşılaşır. Bir hidrojen iyonu bir elektron kabul eder ve hidrojen atomuna dönüşür. Hidrojen atomu diğer bir hidrojen atomuyla ya katodik yüzeye yapışacak ya da daha sonra baloncuk olarak salınacak hidrojen gazı molekülü oluşturmak üzere birleşebilir.
Bazı durumlarda hidrojen atomu, metal kafesine girerek hidrojen gevrekliği yaratabilir.
Bu arada, elektrolitte hidroksil iyonlarıyla birleşen metal iyonları, metal hidroksit (pas)oluşturarak metal yüzeyine çökelir.
Bu süreç devam ettikçe, metal oksidasyonu (korozyon) anotta, hidrojen iyonu indirgenmesi ise katotta oluşur.
Bu arada, elektrolitte hidroksil iyonlarıyla birleşen metal iyonları, metal hidroksit (pas)oluşturarak metal yüzeyine çökelir. Bu süreç devam ettikçe, metal oksidasyonu (korozyon) anotta, hidrojen iyonu indirgenmesi ise katotta oluşur.
Korozyonun İtici Gücü : Gerilim (Voltaj)
Korozyon; elektrik yükünün bir metal yüzeyinden (anot), elektrolite ve elektrolitten ikinci bir metal yüzeyine (katot) akma sürecidir.
Tam bu noktada , elektriksel yükün ilk yüzeyden akmasına neyin sebep olduğu düşünülmelidir.
Gerilim (voltaj), bir elektrolit içine daldırılmış iki elektrot arasındaki elektrokimyasal farkın ölçüsüdür.
Elektrot içine daldırılmış bir metal, potansiyelini ortaya koyarak korozyona uğrayacaktır.
Elektrot potansiyeli, bir birim yükü, elektrot yüzeyinden ve elektrolit içinden referans elektroda hareket ettiren tersinir işi temsil eder.
Elektrot potansiyeli bir standart referans yarı hücreye (elektroda) karşı ölçülür.
Metalin kendisi bir korozyon hücresinin itici güç kaynağı olabilir.
Aynı metal üzerinde voltaj farkı; metalin tane yapısındaki değişikliklerden,alaşımlandırma sırasında oluşan kimyasal kompozisyon farklarından,sıcaklık farkından,üretim esnasında bir kısım yüzeyin deforme olmasından meydana gelebilir.
Metaller, doğada cevher olarak adlandırılan çeşitli kimyasal kompozisyonlarda bulunur. Cevher çıkarıldıktan sonra, içinden metalik bileşen ayrılır ve tamamen saf metal üretmek için rafine edilir. Mekanik, kimyasal, elektriksel prosesler kullanılarak cevherler faydalı metaller haline dönüştürülür. Uygulanan prosesten bağımsız olarak metal, dönüşüm sırasında enerji yüklenir. Rafinasyon sürecinde gereken enerji miktarı bir metalin metalin aktif halini veya voltajını belirler. Voltaj; magnezyum, alüminyum, demir gibi metaller için göreceli olarak yüksek, bakır ve gümüş gibi metaller için göreceli olarak düşüktür. Enerji ne kadar yüksekse, metal o kadar aktif ve korozyon eğilimi o kadar da yüksektir.
Mekanik tesisat sistemlerinde boru, inşaat demiri vb. olacak şekilde çekilir. Demir, toprak-su gibi bir elektrolitle temasa geçince korozyon oluşur. Korozyon sürecinde demir, demiroksit oluşturmak için oksijenle reaksiyona girerken enerji kaybeder. Korozyon ürünü olan pas, topraktan çıkarılan demir cevheri ile aynıdır. Demir, termodinamik olarak kararsız kabul edilir, uygun bir ortamda, düşük enerji seviyesine (daha kararlı hale) pas olarak dönmek için kolayca korozyona uğrar.

Birim etkinlikteki kendi iyonlarını içeren çözeltilere maruz bırakılan metallerin potansiyel farkları tabloda gösterilen standart elektromotor kuvveti serilerinde belirtilmektedir. Bu seride metaller; en asilden en aktife doğru sıralanmıştır.
Eğer iki farklı metal bir elektrolit içinde elektirilksel olarak bağlanırsa daha aktif olan metal korozyon hücresinin anodu olur. Standart elektromotor kuvveti serileri, metallerin korozyon eğilimlerine göre düzenlenmiş bir tablodur.
Cemkimsan Kimya bünyesinde geliştirdiğimiz ve fabrikalarımızda ürettiğimiz bazı su şartlandırma ürünlerimiz;
CEFOPOL 1080; Çok fonksiyonlu kazan suyu şartlandırma kimyasalı.
CEMOLİN 1080; NSF onaylı gıda üretiminde kullanıma uygun buhar hattı korozyon önleyici.
CK-13; Kapalı devre ısıtma soğutma sistemlerinde korozyon önleyici.
CK-42; Kapalı devre ısıtma soğutma sistemlerinde korozyon önleyici.
Kaynak:
Cemkimsan Ders Notları
https://www.kmo.org.tr/resimler/ekler/f51288c412df764_ek.pdf
http://dspace.yildiz.edu.tr/xmlui/bitstream/handle/1/10398/0042247.pdf?sequence=1&isAllowed=y
https://www.metalurji.org.tr/dergi/dergi155/d155_4548.pdf
Resul Ağbulut
Kimya Mühendisi
Su Şartlandırma Danışmanı
Ocak / 2023
